Nanomalzemelerin Katalizdeki Rolü Nedir?
Kataliz, daha düşük aktivasyon enerjisine sahip alternatif bir reaksiyon yolu sağlayarak kimyasal reaksiyonları hızlandıran kimyadaki temel bir işlemdir. Nanomalzemelerin kataliz alanına dahil edilmesi, katalitik verimliliği ve seçiciliği artırmak için nanopartiküllerin benzersiz özelliklerinden yararlanarak bu disiplini önemli ölçüde ilerletiyor.
Bu makale katalizin prensiplerini, tarihsel gelişimini ve çeşitli nanomalzemelerin katalitik performansı iyileştirmedeki yenilikçi uygulamalarını kapsamlı bir şekilde inceliyor. Nanografi ise periyodik tablodaki tüm elementlerin nano ve mikron boyutlarında üretimini ve tedarikini sağlayarak bu alandaki gelişmelere destek veriyor.
Giriş
Metal nanopartiküller, karbon bazlı nanoyapılar ve metal oksitler gibi katalizde kullanılan nanomalzemeler, kimyasal reaksiyonların verimliliğini ve hızını artırmak için son teknoloji bir yaklaşımı temsil eder. Bu malzemeler, yüksek yüzey alanları ve benzersiz elektronik özellikleri sayesinde enerji üretimi, çevresel iyileştirme ve kimyasal sentez gibi çeşitli uygulamalarda önemli bir rol oynar.
Kataliz Nedir?
Bir tepeye ağır bir kutu ittiğinizi hayal edin. Kutuyu hareket ettirmek çok fazla çaba ve enerji gerektirir. Şimdi, tepeye bir rampa koyduğunuzu düşünün. Rampayla kutuyu daha az çabayla yukarı itebilirsiniz. Bu benzetmede, rampa bir katalizör gibidir.
Kimyada kataliz, bir katalizör adı verilen maddenin kimyasal bir reaksiyonu hızlandırmaya yardımcı olduğu bir işlemdir. Rampanın kutuyu daha kolay itmenize yardımcı olması gibi, bir katalizör de bir reaksiyonun gerçekleşmesini kolaylaştırır. Önemli olan, katalizörün kendisinin reaksiyonda tüketilmemesidir; sadece süreci hızlandırır.
Özetle, bir katalizör, kimyasal reaksiyonların hızını artıran ve süreçte tüketilmeyen bir maddedir. Katalizörler, reaktanların ürünlere dönüşümünü daha verimli bir şekilde sağlayarak, daha düşük aktivasyon enerjisine sahip alternatif bir reaksiyon yolu sunar.
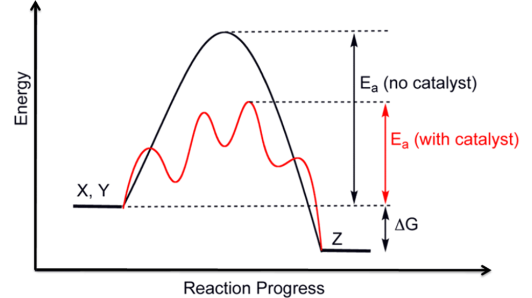
Şekil 1: Kataliz, bir reaksiyonun hızını aktivasyon enerjisini düşürerek artırır.
Katalizin Tarihçesi
Nanopartiküllerin katalizde kullanımı antik çağlara kadar uzanır. Antik Çin ve Mısır'da altın nanopartikülleri, tıbbi ve dekoratif amaçlarla kullanılmıştır. Bilimsel olarak nanopartikül katalizinin keşfi 17. yüzyılda başlamış ve kolloidal nanopartiküller üzerine yapılan çalışmalar temel oluşturmuştur.
19. yüzyılda Michael Faraday, kolloidal altının optik özelliklerini açıklayarak önemli bir adım atmıştır. 20. yüzyılda ise paladyum ve platin nanopartiküllerinin hidrojenasyon reaksiyonlarındaki kullanımı önemli ilerlemeler sağlamıştır.
1987'de Haruta'nın çalışması, 5 nm'den küçük altın nanopartiküllerinin karbon monoksit oksidasyonu için olağanüstü katalitik aktivite gösterdiğini ortaya koymuştur. Bu bulgular, nanokataliz üzerindeki modern araştırmaların gelişimine zemin hazırlamıştır.
Katalizörler Nasıl Çalışır?
Katalizörler, bir kimyasal reaksiyonun hızını artıran ve süreçte tüketilmeyen maddelerdir. Daha düşük aktivasyon enerjisine sahip alternatif bir reaksiyon yolu sağlayarak işlev görürler.
Katalizörlerin nasıl çalıştığını detaylı olarak açıklayalım:
1. Aktivasyon Enerjisini Düşürmek
Her kimyasal reaksiyon, reaktanların ürünlere dönüşmesi için aşılması gereken bir enerji bariyeri içerir. Bu enerji bariyerine aktivasyon enerjisi denir. Katalizörler, bu aktivasyon enerjisini düşürerek reaktanların ürünlere dönüşmesini kolaylaştırır.
2. Ara Ürünlerin Oluşumu
Katalizörler genellikle geçici ara maddelerin oluşumuna katkıda bulunur. Bu ara maddeler, orijinal reaktanlardan daha reaktiftir ve hızla nihai ürünlere dönüşebilir. Katalizörler reaksiyon döngüsünün sonunda yenilenir ve başka bir reaksiyonu kolaylaştırmak için hazır hale gelir.
3. Yüzey Katalizi
Heterojen katalizde, katalizörler genellikle katı fazda bulunur ve tepkime maddeleri farklı bir fazda (genellikle gaz veya sıvı) bulunur. Tepkime maddeleri, katalizörün yüzeyine adsorbe olur ve burada reaksiyona girer. Ürünler yüzeyden desorbe olur ve katalizör değişmeden kalır. Bu süreç şu adımları içerir:
- Adsorpsiyon: Tepkime maddeleri katalizörün yüzeyine bağlanır.
- Tepkime: Tepkime maddeleri yüzeyde etkileşime girer ve ürünler oluşur.
- Desorpsiyon: Ürünler katalizörün yüzeyinden ayrılır.
4. Enzim Katalizi
Biyolojik sistemlerde enzimler katalizör olarak görev yapar. Enzimler, substrat olarak bilinen tepkime maddelerinin bağlandığı oldukça spesifik aktif bölgeler içerir. Enzim-substrat kompleksi, aktivasyon enerjisini düşürerek substratların ürünlere dönüşümünü kolaylaştırır. Enzimler, oldukça seçicidir ve genellikle ılımlı koşullar altında etkili bir şekilde çalışır.
5. Homojen Kataliz
Homojen katalizde, katalizör ve tepkime maddeleri aynı fazda, genellikle sıvıda bulunur. Katalizör, tepkime maddeleriyle bir ara kompleks oluşturur ve ardından ürünleri oluşturmak için reaksiyona girer. Katalizör, reaksiyon sonunda orijinal haliyle serbest bırakılır.
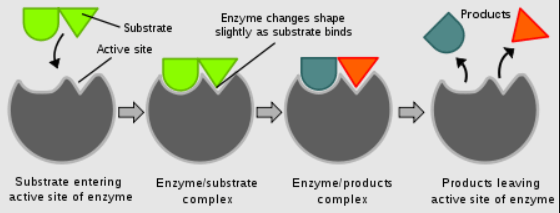
Şekil 2: Katalizin etkisinin şematik gösterimi.
Katalizin Temel Özellikleri
- Belirlilik: Katalizörler genellikle belirli kimyasal reaksiyonlara özgüdür ve bu reaksiyonları hızlandırmada etkilidir.
- Rejenerasyon: Katalizörler, kimyasal reaksiyonlarda tüketilmez. Reaksiyon sonunda orijinal haliyle geri döner ve tekrar tekrar kullanılabilir.
- Seçicilik: Katalizörler, belirli ürünlerin oluşumunu teşvik edebilirken, diğer olası ürünlerin oluşumunu engelleyebilir.
- Verimlilik: Katalizörler, reaksiyon hızını önemli ölçüde artırır. Çoğunlukla reaksiyon hızını birkaç kat artırabilirler.
Katalizde Nanomalzemelerin Kullanımı
Nanomalzemeler, katalizde üstün performans sağlayan benzersiz özellikler sunar. Nanopartiküllerin küçük boyutu, yüzey alanını artırarak daha fazla aktif bölge sağlar ve bu, reaksiyon hızını ve genel verimliliği artırır. Ayrıca, nanopartiküllerin elektronik özellikleri, boyut, şekil ve bileşim değişiklikleri ile ayarlanabilir, böylece katalitik aktivite ve seçicilik optimize edilebilir. Modern nanokataliz uygulamaları arasında CO2 yakalama, hidrojen üretimi ve çevresel iyileştirme bulunur.
Katalizde Nanomalzeme Türleri
Çeşitli nanomalzeme türleri, farklı katalitik uygulamalar için farklı avantajlar sunar:
Metal Nanopartiküller
Platin, paladyum ve altın gibi metal nanopartiküller, hidrojenasyon, oksidasyon ve birleştirme reaksiyonlarındaki katalitik özellikleri ile dikkat çeker. Bu nanopartiküller, hafif koşullar altında reaksiyonları kolaylaştırma ve yüksek seçicilik sağlama yetenekleri ile etkilidir.
Metal nanopartiküller, mevcut yüzey alanını ve aktif bölgeleri artırmak için destek malzemeleri üzerine dağıtılabilir. Ayrıca, metallerin nanoskalada alaşımlanması, örneğin platinin paladyumla birleştirilmesi, gelişmiş katalitik özellikler sunar.
Metal Oksit Nanopartiküller
Titanyum dioksit, çinko oksit ve seryum oksit gibi metal oksitler, hem katalizör hem de destek malzemesi olarak kullanılır. Kararlılıkları ve reaktiflikleri nedeniyle fotokataliz ve çevresel iyileştirme süreçlerinde önemli rol oynar.
Örneğin, titanyum dioksit (TiO2) üzerinde desteklenen platin nanopartiküller, çevresel temizleme süreçlerinde fotokatalitik aktiviteyi artırır. Çekirdek-kabuk yapıları, bir tür nanopartikülün çekirdeği ile başka bir malzemenin kabuğunu kullanarak katalitik verimliliği artırır; örneğin, yakıt hücrelerinde platin kabuk ve altın çekirdek kullanımı gibi.
Karbon Bazlı Nanomalzemeler
Karbon nanotüpler, grafen ve fullerenler gibi karbon bazlı nanomalzemeler, yüksek elektriksel iletkenlik, geniş yüzey alanı ve kimyasal kararlılık sunar. Bu özellikler, elektrokataliz ve heterojen kataliz gibi çeşitli katalitik işlemler için uygundur.
Karbon nanotüpler, asidik gruplarla işlevselleştirilerek belirli katalitik reaksiyonlarda performanslarını artırabilir. Ayrıca, aktif nanokatalizörleri yarı iletkenler veya plazmonik parçacıklarla entegre etmek, güneş enerjisinden yakıta dönüşümde karbon bazlı malzemelerin kullanılmasını ve foto-indüklenmiş katalitik reaksiyonları kolaylaştırabilir.
Sonuç
Nanomalzemeler, yenilenebilir enerji teknolojilerinde fotokatalitik ve elektrokatalitik süreçler için önemli çözümler sunar. Kompozit nanomalzemelerin geliştirilmesi ve nanoyapıların stratejik tasarımı, endüstriyel zorlukları ve gelecekteki teknolojik ihtiyaçları ele alarak iyi bir katalitik aktivite ve kararlılık sağlar. Araştırmalar ilerledikçe, akademi ve endüstri arasındaki iş birliği, nanokatalizörlerin potansiyelini açığa çıkaracak ve sürdürülebilir kimyasal süreçler için yeni uygulamalar sağlayacaktır.
Nanoteknoloji alanlarında öğretici ve güncel gelişmeler hakkında daha fazla bilgi almak için Blografi'yi takip edin.
Kaynakça
Khalil, M., Kadja, G. T. M., & Ilmi, M. M. (2021). Advanced nanomaterials for catalysis: Current progress in fine chemical synthesis, hydrocarbon processing, and renewable energy. Journal of Industrial and Engineering Chemistry, 93, 78–100. https://doi.org/10.1016/J.JIEC.2020.09.028
Kolloidal altın - Vikipedi. (n.d.). Retrieved August 5, 2024, from https://tr.wikipedia.org/wiki/Kolloidal_alt%C4%B1n
Michael Faraday’s gold colloids | Royal Institution. (n.d.). Retrieved August 5, 2024, from https://www.rigb.org/explore-science/explore/collection/michael-faradays-gold-colloids
Okumura, M., Fujitani, T., Huang, J., & Ishida, T. (2015). A Career in Catalysis: Masatake Haruta. ACS Catalysis, 5(8), 4699–4707. https://doi.org/10.1021/ACSCATAL.5B01122/ASSET/IMAGES/MEDIUM/CS-2015-01122U_0005.GIF
Retrieved August 5, 2024, from https://www. https://ch302.cm.utexas.edu/kinetics/catalysts/catalysts-all.php
What Is a Catalyst? Understand Catalysis. (n.d.). Retrieved August 5, 2024, from https://sciencenotes.org/what-is-a-catalyst-understand-catalysis/
Yentekakis, I. V., Gournis, D. P., & Karakassides, M. A. (2023). Nanomaterials in Catalysis Applications. Catalysts 2023, Vol. 13, Page 627, 13(3), 627. https://doi.org/10.3390/CATAL13030627
Recent Posts
-
5G Teknolojisi ve İleri Malzemeler ile Geleceğin İletişimi
5G teknolojisi, daha hızlı bağlantı hızları, düşük gecikme süreleri ve geniş kapsam alanıyla iletişi …28th Jan 2025 -
Yapay Zeka ve Nanoteknolojinin Tıptaki Gücü
Son on yılda yapay zeka (AI), tıp da dahil olmak üzere birçok alanda önemli ilerlemeler kaydetmiş ve …17th Jan 2025 -
Grafen Sensörlerle Yeni Nesil Sağlık İzleme
Günümüzde kronik hastalıkların, özellikle kardiyovasküler ve solunum yolu rahatsızlıklarının yaygınl …15th Jan 2025





